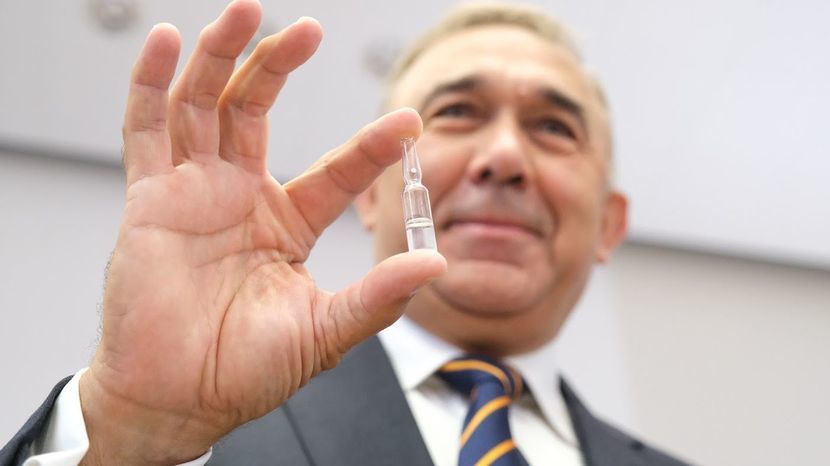
Jest zgoda na rozpoczęcie badań klinicznych preparatu wyprodukowanego z osocza ozdrowieńców przez lubelską spółkę Biomed. Weźmie w nich udział 500 pacjentów

- Szpital Kliniczny nr 1 w Lublinie dostał dzisiaj zgodę Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Ośrodki, które biorą udział w tym projekcie mogą rozpocząć badania kliniczne immunoglobuliny anty-SARS-CoV-2 - informuje Piotr Fic, p.o. prezesa Biomedu.
- Ze względu na to, że badania będą prowadzone w kilku ośrodkach, trudno na razie powiedzieć ile będą trwały w każdym z nich, kiedy zostanie podana pierwsza dawka i kiedy będzie można mówić o efektach leczenia. Pierwsze wyniki będzie można obserwować już kilka dni po podaniu preparatu pierwszemu pacjentowi, ale szpital nie może informować o wynikach cząstkowych - tłumaczy Fic.
Badania kliniczne, w których weźmie udział 500 pacjentów, będą prowadzone w czterech ośrodkach:
- Lublinie,
- Bytomiu,
- Białymstoku,
- Warszawie.
Wiodącym ośrodkiem jest lubelska Klinika Chorób Zakaźnych SPSK1, którą kieruje dr hab. n. med. Krzysztof Tomasiewicz. Po potwierdzeniu skuteczności terapii i określeniu dawki terapeutycznej, preparat będzie mógł wejść w fazę rejestracji. Może to zająć od kilku do kilkunastu miesięcy.
Biomed wyprodukował trzy tysiące ampułek immunoglobuliny anty-SARS-CoV-2. 150 litrów osocza potrzebnego do produkcji zostało zebrane przez siedem Regionalnych Centrów Krwiodawstwa i Krwiolecznictwa, w tym m.in. w Lublinie.